Koolstof-zuurstof-anion

In de chemie is een koolstof-zuurstof-anion (KZA) een negatief geladen ion dat slechts bestaat uit de elementen zuurstof en koolstof. De algemene formule voor zo'n deeltje is dan: . x, y en z zijn in deze formule hele getallen.
De meest bekende KZA's zijn het carbonaat-, , en het oxalaat-ion, . Naast deze twee bekende vertegenwoordigers is er nog een groot aantal andere KZA's die in de chemische research of zelfs in de industrie een rol spelen. Daarnaast is er ook een aantal onstabiele ionen, zoals en , die kortstondig bestaan tijdens bepaalde chemische processen, evenals een grote groep hypothetische ionen als Sjabloon:Nowrap die onderwerp zijn van theoretische studies, maar tot nu toe (2021[1]) niet zijn waargenomen.
Stabiele KZA's vormen zouten met een grote verscheidenheid aan kationen. Onstabiele ionen kunnen soms bestaan onder zeer speciale omstandigheden, zoals in het interstellair gas. Veel KZA's hebben corresponderende functionele groepen in de organische chemie, meestal in de vorm van esters. Zo komt de oxalaat-eenheid voor in de ester dimethyloxalaat: Sjabloon:Nowrap
Electronische structuur van het carbonaat-ion
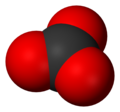
De atomen in het carbonaat-ion vormen een gelijkzijdige, vlakke driehoek, met het koolstof-atoom in het zwaartepunt en de zuurstof-atomen op de hoeken. De puntgroep is D3h[2] . De drie C-O-bindingen zijn even lang (136 pm en de hoeken tussen ze bindingen zijn 120°. Het koolstofatoom heeft 4 paren elektronen in zijn valentieschil, waarmee het ion voldoet aan de octetregel. Dit is een van de factoren die bijdragen aan de grote stabiliteit van het ion, dat onder andere voorkomt als kalksteen. Voor de beschrijving van de elektronische structuur van het ion worden twee verschillende manieren gebruikt, elk beschrijft op zijn eigen wijze hoe 4 elektronenparen verdeeld worden over slechts 3 C-O-bindingen.
In de valentiebindingstheorie wordt het ion beschreven als een resonantiegemiddelde van 3 klassieke structuren.
In elk van de klassieke structuren zijn er tussen koolstof en de zuurstof-atomen twee enkele banden en een dubbele band aanwezig. De drie vormen zijn in essentie gelijk en dragen elk evenveel bij aan de uiteindelijke structuur, waardoor de C-O-bindingen allemaal even lang worden.

In de molecuulorbitaaltheorie wordt de drievoudige symmetrie-as loodrecht op het vlak van de atomen door het koolstof-atoom aangeduid als de z-as van het molecuul. Drie σ-bindingen worden gevormd uit de tot sp2 gehybridiseerde s-, px- en py-orbitalen op het koolstof-atoom met een p- orbitaal op elk van de zuurstofatomen. Hier overheen wordt een gedelocaliseerde π-binding gevormd door overlap van de pz-orbitaal op koolstof en de pz-orbitalen op elk van de zuurstof-atomen.
Het zelfde bindingsschema geldt ook voor het nitraat-ion, dat isoelektronisch is met het carbonaat-ion.
Op dezelfde wijze kan de elektronische structuur van de carboxylaatgroep beschreven worden als een resonantie-evenwicht tussen twee klassieke vormen in de valentietheorie of met twee σ-bindingen en een daaroverheen liggend π-systeem in de orbitaaltheorie:
Verwante verbindingen
Koolstof-zuurstof-zuren
Een KCA, , kan beschreven worden als het resultaat van het verwijderen van alle protonen van het corresponderende zuur, . Carbonaat, , bijvoorbeeld, kan beschouwd worden als het anion van koolzuur, . Soms is het "zuur" eigenlijk een alcohol of ander deeltje, zoals bijvoorbeeld voor ethyndiolaat, dat ontstaan gedacht kan worden uit ethyndiol, . Het anion is echter vaak veel stabieler dan het overeenkomende zuur, zoals bij carbonaat[3] en soms is het zuur zelfs onbekend of wordt op theoretische gronden aangenomen dat het zuur zeer instabiel zal zijn, zoals in het geval van methaantetracarboxylaat: .
Neutrale deeltjes
Naast de hierboven beschreven neutralisatie met een zuur, kan een KZA, in principe ook neutraal gemaakt worden, met het zelfde aantal koolstof- en zuurstof-atomen, maar zonder lading, via oxidatie:
In de regel zijn deze neutrale verbindingen minder stabiel dan de KZA's waarvan ze zijn afgeleid. Zo correspondeert het zeer stabiele carbonaat-ion met het extreem instabiele neutrale koolstoftrioxide, [4]. Oxalaat, corresopondeert met het zelfs nog instabielere 1,2-dioxetaandion, .[5] en het stabiele croconaat-anion, correspondeert met het neutrale cyclopentaanpenton, , waarvan alleen sporen zijn aangetoond.[6]
Gereduceerde varianten
Naast oxidatie is ook reductie in principe mogelijk: er ontstaan deeltjes met dezelfde molecuulformule, maar met een hogere negatieve lading. Zo kan rhodizonaat, tot het tetrahydroxy-1,4-benzochinon-anion, en uiteindelijk tot naar het benzeenhexol-anion, gereduceerd worden.[7]
Zuuranhydrides
Een KCA, , kan ook gekoppeld worden aan het anhydride van het overeenkomstige zuur. Dit anhydride op zijn beurt is ook onderdeel van de koolstof-zuurstof-familie met de formule (elke lading staat vanuit het zuur bezien voor een waterstof-atoom, dus is de helft van de lading aan zuurstof-atomen vertrokken tijdens de anhydride-vorming). De standaard relatie is die tussen carbonaat en . De overeenkomst is niet altijd meteen zichtbaar omdat er meerdere mogelijkheden kunnen zijn om de formele dehydratatie uit te voeren, inclusief het combineren van twee of meer anionen, waarbij oligomeren ontstaan. In tegenstelling tot het neutraliseren of oxideren naar neutrale componenten kunnen anhydrides soms verrassend stabiel zijn, zoals het aan mellitinaat, , gerelateerde mellitinezuuranhydride, .[8][9][10]
Gedeeltelijk geneutraliseerde anionen
Voor elk KZA kunnen in principe z-1 gedeeltelijk geprotoneerde anionen bestaan met de formule Sjabloon:Nowrap Deze anionen worden algemeen beschreven met de voorvoegsels (mono)waterstof-, diwaterstof-, triwaterstof-, enzovoort. Sommige hebben vanuit de geschiedenis nog veel gebruikte triviale namen: zo wordt waterstofcarbonaat nog vaak als bicarbonaat benoemd en waterstofaxalaat als binoxalaat.
De waterstofanionen kunnen stabiel zijn terwijl de volledig geprotoneerde anionen niet staboiel zijn. Bicarbonaat is hiervan het bekendste voorbeeld.
Overzicht van koolstof-zuurstof-anionen
Onderstaande tabel geeft een (niet uitputtend !) overzicht van koolstof-zuurstof-anionen.
Van verschillende andere KZA's is het bestaan op microniveau aangetoond tijdens diverse experimenten. is daarvan een voorbeeld, een eenwaardige variant van rhodizonaat.[11]
- ↑ Het jaartal is afgeleid uit dat van de laatste referentie-datum in het Engelse lemma.
- ↑ De symmetrie-aanduiding D3h betekent dat het molecuul een spiegelvlak heeft (door alle atomen), en loodrecht daarop een drievoudige rotatieas (door het koolstof-atoom): na draaiing over een hoek van 360/3 graden is "hetzelfde molecuul" ontstaan.
- ↑ "Infrared and mass spectral studies of proton irradiated H2O + CO2 ice: evidence for carbonic acid", by Moore, M. H.; Khanna, R. K.
- ↑ Sjabloon:Cite journal
- ↑ Sjabloon:Cite journal
- ↑ Sjabloon:Cite journal
- ↑ Haiyan Chen, Michel Armand, Matthieu Courty, Meng Jiang, Clare P. Grey, Franck Dolhem, Jean-Marie Tarascon, and Philippe Poizot (2009), "Lithium Salt of Tetrahydroxybenzoquinone: Toward the Development of a Sustainable Li-Ion Battery" J. Am. Chem. Soc., 131(25), pp. 8984–8988 Sjabloon:Doi
- ↑ J. Liebig, F. Wöhler (1830), "Ueber die Zusammensetzung der Honigsteinsäure" Poggendorfs Annalen der Physik und Chemie, vol. 94, Issue 2, pp.161–164. Online version accessed on 2009-07-08.
- ↑ Sjabloon:Cite journal
- ↑ Sjabloon:Cite journal
- ↑ Richard B. Wyrwas and Caroline Chick Jarrold (2006), "Production of from Oligomerization of CO on Molybdenum Anions". J. Am. Chem. Soc. volume 128 issue 42, pages 13688–13689. Sjabloon:Doi



